Avete presente lo spot pubblicitario in cui un impiegato, mentre tenta di prendere un caffè durante la pausa, si ritrova di fianco il collega con in mano un estintore benché non ci sia il minimo indizio di un incendio? Alla comprensibile richiesta di spiegazioni, lo strano personaggio risponde che si sta proteggendo dal fuoco di Sant’Antonio. Questa campagna, così come quella “#mivaccinononmiaccendo” promossa dall’associazione Italia Longeva per l’invecchiamento e la longevità attiva, altro non sono che tentativi di informare le persone oltre i 65 anni del vaccino contro l’Herpes zoster, virus responsabile di una fastidiosa e potenzialmente pericolosa eruzione cutanea nota come fuoco di Sant’Antonio.
Ma perché il vaccino anti-herpes zoster, così come quello antinfluenzale, è consigliato e offerto gratuitamente proprio a questa fascia di età? È come se si desse per scontato che, a partire da una certa età, il corpo diventi meno capace di contrastare i potenziali attacchi di microrganismi patogeni. Effettivamente, negli anziani – anche in assenza di vere e proprie patologie – ciò che avviene è un cambiamento dei sistemi di difesa che rende il nostro sistema immunitario meno responsivo. La letteratura scientifica ha tentato di dare una spiegazione a questo fenomeno, identificando come possibile causa un cambiamento del midollo osseo e in particolare delle cellule staminali che danno origine a quelle che circoleranno poi nel sangue, responsabili del processo noto come emopoiesi.
Tagli al personale per le cellule del midollo osseo
Il cambiamento più evidente in un midollo invecchiato è una notevole riduzione della cellularità. Si pensi che dopo i 65 anni la percentuale di cellule è solo il 30% rispetto a quella di un giovane adulto. Lo spazio rimasto vacante viene progressivamente occupato da tessuto adiposo, cioè grasso; lo stesso fenomeno si verifica anche in un altro organo fondamentale per la maturazione del nostro sistema immunitario: il timo. In passato considerato “il cimitero dei linfociti T”, dagli anni Sessanta il timo è riconosciuto per il suo ruolo chiave nella loro maturazione, un po’ come se fosse un collegio educativo per futuri combattenti. Non è ben chiaro se l’accumulo di grasso nel timo e nel midollo osseo siano la causa o la conseguenza dell’invecchiamento di questi organi, così come è ancora oggetto di discussione se le modifiche età-correlate che si verificano nel midollo osseo abbiano una relazione con i cambiamenti del timo, che peraltro avvengono in età più giovane, già intorno ai 30 anni. In ogni caso, ciò comporta un netto taglio del personale nel sistema immunitario, ovvero una riduzione delle cellule necessarie per la difesa del nostro organismo.
Non è però solo una questione di numeri. Il midollo osseo si modifica anche in termini qualitativi e questo potrebbe spiegare alcune alterazioni (a volte impercettibili) negli esami del sangue rispetto al passato, come la lieve anemia dell’anziano o una modifica della formula leucocitaria, ma anche la maggiore predisposizione degli anziani alle infezioni o la ridotta risposta ai vaccini, più comune nella terza età. Vediamo come.
Fanteria e cavalleria: l’esercito a difesa del nostro organismo
Si potrebbe paragonare l’insieme di cellule mieloidi e linfoidi del nostro sistema immunitario a un grande esercito costituito da combattenti con diverse funzioni e responsabilità. Le cellule mieloidi, come i neutrofili, i monociti e i macrofagi, costituiscono la fanteria, i soldati appiedati che sono i primi a fronteggiare il nemico. Sono infatti responsabili della risposta acuta a un attacco improvviso e spesso inaspettato (immunità innata). Poi viene la cavalleria (immunità adattativa), capitanata dalle cellule linfoidi come i linfociti B e T, che nel frattempo ha avuto il tempo di pianificare l’attacco, difendendosi in modo più efficace e facendo tesoro delle strategie utilizzate per sfruttarle in caso di un futuro secondo attacco da parte dello stesso nemico (un fenomeno noto come memoria immunitaria). A ciascuno i propri compiti, quindi.
Il problema è che, con l’invecchiamento, la composizione dell’esercito diventa sbilanciata, con una predominanza di soldati intraprendenti che scalpitano per combattere subito e una progressiva riduzione della cavalleria. È proprio questa la chiave per comprendere la complessa trasformazione del nostro midollo osseo dalla giovane alla terza età: l’evento fondamentale è il passaggio da un’emopoiesi bilanciata a quella sbilanciata verso la linea mieloide o, per dirla all’inglese, myeloid-skewed. In pratica, le cellule staminali del sangue sono indotte a differenziarsi maggiormente verso cellule mieloidi responsabili dell’immunità innata, che predomineranno su quelle linfoidi. Il nostro sistema immunitario sarà quindi in grado di reagire all’infiammazione, ma in modo poco specifico, poco durevole. Soprattutto, come spesso avviene nella terza età, anche le cellule immunitarie diventeranno un po’ smemorate, con una minore capacità di ricordare l’origine dell’attacco, proprio a causa della riduzione della linea linfoide responsabile della memoria immunitaria a lungo termine.
Inflammaging
L’aumento del numero delle cellule staminali mieloidi induce anche l’accumulo di molecole proinfiammatorie (citochine) da esse prodotte, come le interleuchine (IL) IL-6, l’IL-1β o il fattore di necrosi tumorale (tumor necrosis factor, o TNF), che contribuiscono a uno stato di infiammazione cronica legata all’invecchiamento noto come inflammaging (un tema di cui AgingProject si è già occupata in passato). Nel midollo osseo si delinea uno scenario di infiammazione cronica a basso grado a cui le cellule emopoietiche si adattano male. Anche l’infiammazione cronica sembra modificare ulteriormente l’equilibrio all’interno della nicchia emopoietica, creando un ambiente che favorisce ulteriormente l’espansione delle cellule staminali mieloidi in un circolo vizioso di infiammazione e sbilanciamento emopoietico che in alcuni casi può perdere il controllo, favorendo l’accumulo di mutazioni nelle cellule staminali mieloidi e portando alla formazione di cloni maligni. Non è un caso che la forma più comune di leucemia acuta nell’anziano sia proprio la leucemia mieloide, mentre le forme che colpiscono la linea linfoide sono più tipiche dei bambini e dei giovani.
Le cause di una bilancia mal tarata
Resta da chiedersi quale sia l’origine di questo sbilanciamento. Per comprendere ciò, è bene sapere che le cellule staminali emopoietiche vivono in stretta relazione con altre cellule note come cellule stromali mesenchimali, che costituiscono la struttura del midollo osseo e che creano e mantengono l’ambiente ottimale per far sentire a proprio agio le cellule staminali, una sorta di appartamento accogliente noto come “nicchia emopoietica”.
In una nicchia giovane, le cellule stromali, oltre a fornire supporto fisico. rilasciano una serie di segnali di crescita e fattori di mantenimento come il fattore di crescita insulino-simile 1 (insulin-like growth factor, o IGF-1) e il ligando del recettore kit. Questi segnali sono essenziali per mantenere lo stato di quiescenza delle staminali, la capacità di autorigenerarsi e differenziarsi in modo bilanciato e per proteggerle dallo stress ossidativo. Con l’invecchiamento, però, la produzione di IGF-1 e del ligando del recettore kit diminuisce, compromettendo soprattutto la differenziazione verso la linea linfoide, a favore della sola mielopoiesi.
Infine, a cambiare è anche l’apporto di sangue al midollo, ben irrorato in giovane età, molto meno nell’anziano. L’ipossia (ridotto apporto di ossigeno) e il ridotto apporto di nutrienti essenziali per le cellule staminali finiscono per favorire la proliferazione di quelle che sanno meglio adattarsi a condizioni ambientali sfavorevoli, che, tanto per cambiare, sono le cellule staminali mieloidi.
Anche il midollo osseo va dal chirurgo estetico
Tutto ciò è molto interessante da sapere e fa almeno comprendere la verosimile causa del lieve stato di depressione delle difese in un anziano, ma quali sono i potenziali risvolti nel campo della terapia? In altre parole, sarebbe possibile contrastare questi cambiamenti per ringiovanire il midollo, facendolo tornare ai tempi d’oro dei vent’anni?
La maggior parte degli studi è stata effettuata su modelli animali con l’obiettivo di sovvertire il tipico sbilanciamento di linea che caratterizza un midollo anziano, ripristinando quindi l’equilibrio tra popolazione mieloide e linfoide. Sfortunatamente, si è visto che né il trapianto di cellule staminali vecchie in topi giovani, né l’infusione di plasma di topi giovani in topi vecchi sono stati in grado di ringiovanire le cellule staminali, segno che la biologia di questa popolazione cellulare e del microambiente che popolano è molto più complessa di quanto sembri e che forse è più opportuno agire direttamente sulla nicchia emopoietica stessa se si vogliono ottenere risultati più promettenti.
Gli approcci sono essenzialmente due:
- agire sul microambiente popolato dalle cellule staminali per ridurre tutti quegli eventi esterni che possono alterare la bilancia emopoietica, come l’infiammazione o la scarsa vascolarizzazione;
- agire direttamente sulle cellule considerate responsabili dello sbilanciamento, tentando di ridurre le staminali mieloidi per riequilibrare mielopoiesi e linfopoiesi.
Per quanto riguarda la prima strategia, si è visto che la stimolazione di colture di cellule staminali con IGF-1, il fattore di crescita che tende a diminuire con l’età, ha promosso la proliferazione soprattutto della linea linfoide. In alcuni esperimenti su topi in vivo, invece, l’iniezione di un antagonista della molecola proinfiammatoria interleuchina-1 ha spostato l’equilibrio a favore delle cellule linfoidi, indicando che la riduzione dell’infiammazione potrebbe essere una strategia per ringiovanire il midollo. Infine, senza voler aprire un intero capitolo a parte sulla stretta relazione tra infiammazione e microbiota, basti dire che un esperimento di trapianto fecale da topi giovani a topi anziani ha migliorato la funzionalità delle cellule staminali emopoietiche di questi ultimi, riducendo l’infiammazione cronica legata all’età.
L’altra strategia sarebbe invece quella di invitare caldamente gli “ospiti scomodi” del midollo, ovvero le cellule staminali myeloid-skewed in eccesso, ad andarsene lasciando più spazio alla linea linfoide. Si è visto ad esempio che queste cellule esprimono in superficie alcuni marcatori molecolari specifici (CD150, CD62p, CD41, NEO1), che potrebbero essere perfetti bersagli di anticorpi monoclonali da usare come terapia. Un recente protocollo sperimentale su topi trattati con questa strategia ha dimostrato un aumento del rapporto tra cellule linfoidi e mieloidi fino a quattro volte, una riduzione dell’infiammazione sistemica anche parecchi mesi dopo il trattamento e una migliore risposta a un vaccino anti-virale.
Un’altra possibile via di intervento potrebbe essere la restrizione calorica. Ebbene sì, uno studio in cui l’introito calorico dei topi è stato ridotto del 30% per 9 mesi ha portato a una riduzione delle cellule staminali sbilanciate verso la linea mieloide. Allo stesso tempo, però, è stata compromessa anche la proliferazione della linea linfoide, segno che probabilmente la restrizione calorica, da sola, non è sufficiente a sovvertire il disequilibrio e potrebbe essere addirittura controproducente. Meglio allora usarla come approccio complementare ad altre strategie terapeutiche, anche perché, tra gli interventi, quello basato sulla dieta risulta essere tra i più accessibili e semplici da realizzare.
Il nostro midollo è quindi in continua evoluzione, da quando il feto si sviluppa nel ventre materno fino all’ultimo giorno di vita. Le complesse relazioni tra le future cellule del sangue che lo popolano e le cellule stromali che ne costituiscono la struttura condizionano l’aspetto e il carattere delle staminali nel corso del tempo, un concetto che è stato definito come pleiotropia antagonistica: lo stesso patrimonio genetico si traduce in diverse caratteristiche morfologiche e funzionali (fenotipi) che variano a seconda dell’età dell’individuo e spesso hanno conseguenze opposte (come si può vedere in figura). Lo spostamento dell’ago della bilancia verso la linea mieloide ne è un perfetto esempio e le strategie per tentare di ringiovanire il midollo potrebbero essere dei veri e propri tentativi di medicina rigenerativa per contrastare la lieve ma inevitabile perdita di vigore del nostro sistema immunitario.
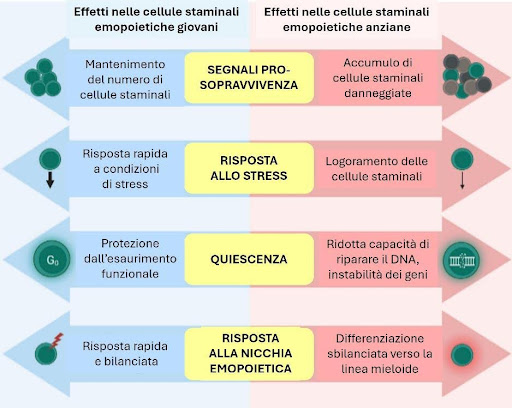
Ad esempio, i meccanismi che, in giovane età, promuovevano la sopravvivenza delle cellule staminali per mantenerne un buon numero, durante la vecchiaia giocano a loro stesso sfavore promuovendo l’accumulo di mutazioni, oppure lo stato di quiescenza in cui le cellule staminali sono state mantenute per quasi tutta la vita diventa responsabile di una ridotta capacità di riparare eventuali danni al DNA che iniziano ad accumularsi nel tempo, dando origine a mutazioni e possibili trasformazioni verso cellule tumorali.
Per riassumere meglio i concetti esposti in questo articolo, si consiglia la visione del video del Prof. Francesco Albano (Università di Bari)
Riferimenti bibliografici
- Fisman DN, Bogoch I, Lapointe-Shaw L, McCready J, Tuite AR. Risk Factors Associated with Mortality among Residents with Coronavirus Disease 2019 (COVID-19) in Long-term Care Facilities in Ontario, Canada. JAMA Netw Open. 2021;225(7):1129-1140. doi:10.1001/JAMANETWORKOPEN.2020.15957
- Kasbekar M, Mitchell CA, Proven MA, Passegué E. Hematopoietic stem cells through the ages: A lifetime of adaptation to organismal demands. Cell Stem Cell. 2023;30(11):1403-1420. doi:10.1016/J.STEM.2023.09.013
- Longo DL. Bone Marrow in Aging: Changes? Yes; Clinical Malfunction? Not So Clear. Blood. 2008;112(11):sci-1. doi:10.1182/BLOOD.V112.11.SCI-1.SCI-1
- Prabhakar M, Ershler WB, Longo DL. Bone Marrow, Thymus and Blood: Changes Across the Lifespan. Aging health. 2009;5(3):385-393. doi:10.2217/AHE.09.31
- Ross JB, Myers LM, Noh JJ, et al. Depleting myeloid-biased haematopoietic stem cells rejuvenates aged immunity. Nat 2024 6288006. 2024;628:162-170. doi:10.1038/s41586-024-07238-x
- Tang D, Tao S, Chen Z, et al. Dietary restriction improves repopulation but impairs lymphoid differentiation capacity of hematopoietic stem cells in early aging. J Exp Med. 2016;213(4):535-553. doi:10.1084/JEM.20151100
- Young KA, Telpoukhovskaia MA, Hofmann J, Mistry JJ, Kokkaliaris KD, Trowbridge JJ. Variation in mesenchymal KITL/SCF and IGF1 expression in middle age underlies steady-state hematopoietic stem cell aging. Blood. 2024;144(4):378-391. doi:10.1182/BLOOD.2024024275




